膠芽腫における免疫療法という選択肢
膠芽腫(GBM)は、成人に発生する脳腫瘍の中でも最も悪性度が高い腫瘍で、標準治療(最大限の腫瘍摘出手術+放射線+テモゾロミド)を行っても、5年生存率は10%未満と報告されています。「再発率が高い」「治療選択肢が限られる」という現実を前に、手術前後の患者さんとご家族が積極的に情報を集めることはとても大切です。
その中で注目されているのが、自家がんワクチン(AFTV)療法です。
この記事では、2006〜2021年に診断されたGBM患者375例を対象した2025年の論文情報(東京女子医科大学)を共有します。
目次
自家がんワクチンとは?
自家がんワクチンは、患者さん自身の摘出腫瘍を材料にして作る「オーダーメイド免疫療法」です。手術で取り出した腫瘍組織をホルマリン固定し、そこに含まれる腫瘍特異的抗原を免疫に学習させることで、体内に残存する腫瘍細胞を標的に攻撃できるように設計されています。広く正常細胞に影響しにくく、安全性が高いことが特徴です。
ポイント
- 患者さん固有の腫瘍抗原に合わせた「個別化(オーダーメイド)」
- 標準治療と併用可能(実臨床でも併用で検証)
- 重篤な副作用の報告は少ない(局所反応が中心)
免疫療法は膠芽腫(GBM)に対する有望な治療法のひとつです。 腫瘍特異的抗原に対する免疫応答を誘導することで、悪性細胞の排除を目指します(Sener et al. 2022)。
その中でも、 自家ホルマリン固定腫瘍ワクチン(AFTV) は、有力な選択肢として注目されています。 AFTVは患者さん自身の腫瘍組織をホルマリン固定し、腫瘍特異的抗原を免疫系に提示することで、標的型の免疫応答を引き出します。
臨床試験の結果:
- Phase I/II 試験では、AFTVを放射線療法+テモゾロミド(TMZ)と併用した場合、OS中央値 19.8か月、2年生存率 40%(Ishikawa et al. 2014; Muragaki et al. 2011)
- Phase IIb 試験では、肉眼的全摘出(GTR)を受けた患者で3年OS 80%、3年PFS 81% を記録(Muragaki et al. 2023)
- これらの結果は、AFTV療法がGBM患者の長期予後改善に寄与する可能性を示唆しています。
- 安全性が高く、標準治療の補助として有効な治療オプションとなり得ます。
2025年の研究
日本の研究グループ(東京女子医科大学)が、新規膠芽腫患者375例を対象にAFTVの有効性を検証。
- AFTV群:標準治療(最大限切除+RT+TMZ)に加え、AFTVを皮下注で3回投与
- 評価項目:PFS(Progression-Free Survival:無増悪生存期間)、OS(Overall Survival:全生存期間)、分子病理マーカー(IDH、p53、PD-L1)との関連
2006年から2021年の間に東京女子医科大学で新規に膠芽腫(GBM)と診断された477例のうち、標準治療を受け、十分なフォローアップデータが得られた416例が解析対象となりました。 さらに、41例の生検のみの患者を除外し、最大限の切除を受けた375例が評価対象となりました。
本研究では、AFTV療法を受けた患者164例(AFTV群)と、標準治療のみの患者211例(非AFTV群)で構成されています。 AFTV群の中央値年齢は51.2±14.4歳、非AFTV群は56.1±15.1歳であり、統計的に有意な差がありました(p<0.01)。 年齢の差があるため、高齢患者におけるAFTV療法の効果も別途解析され、年齢による影響を考慮しています。
性別比、Karnofsky Performance Status(KPS)、左右差、腫瘍局在については両群間で統計的に有意な差は認められませんでした。 患者背景の詳細は、以下のTable 1にまとめています。
Table 1: 患者背景(Baseline characteristics of the study population)
| 項目 | AFTV群 (n=164) | 非AFTV群 (n=211) | p値 |
|---|---|---|---|
| 性別 (男性/女性) | 103 / 61 | 116 / 95 | 0.16 |
| 年齢 (平均 ± SD, 歳) | 50.6 ± 14.6 | 55.8 ± 15.4 | < 0.01 |
| 左右差 (右/左) | 53 / 48 | 50 / 52 | 0.25 |
| 腫瘍局在 |
前頭葉 31.8% 頭頂葉 19.6% 側頭葉 36.4% その他 12.1% |
前頭葉 40.0% 頭頂葉 15.7% 側頭葉 23.5% その他 20.9% |
0.26 |
| 術前 KPS ≥80 / ≤70 | 64.8% / 35.2% | 50.0% / 50.0% | 0.40 |
| 腫瘍サイズ (平均 ± SD, mm) | 51.4 ± 17.2 | 45.3 ± 15.7 | < 0.01 |
※ Koriyama et al., 2025. Brain Tumor Pathology, 42:76–86. より作成。
主な結果
AFTVを受けた患者さん(164例)は、受けていない患者さん(211例)に比べて無増悪生存期間(PFS)・全生存期間(OS)が有意に延長しました(Koriyama et al. 2025)。
| 転帰指標 | AFTVあり | AFTVなし | 統計 |
|---|---|---|---|
| 無増悪生存期間(PFS)中央値 | 14.0か月 | 8.7か月 | p=0.03 |
| 全生存期間(OS)中央値 | 32.0か月 | 21.9か月 | p<0.01 |
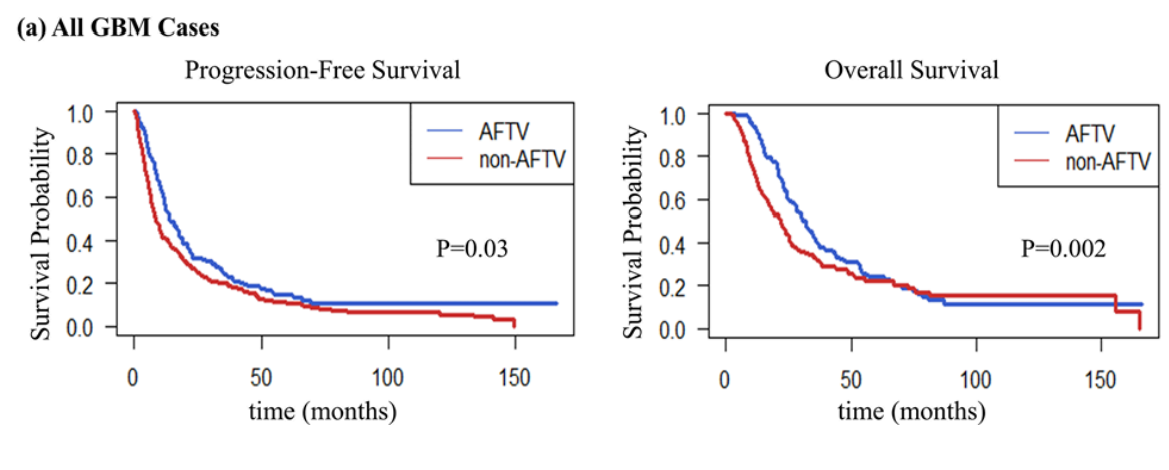
Fig.1 (a)出典: Koriyama, S. et al., 2025. Brain Tumor Pathology, 42:76–86, Fig. 1. CC BY 4.0. 詳細はPubMedをご参照ください。
サブグループ解析
- 65歳以上:OS中央値 27.3か月 vs 17.0か月(p<0.01)
- 早期再発(術後6か月以内):OS中央値 15.1か月 vs 9.5か月(P<0.01)
→高リスク群でも有効性を示す結果です。
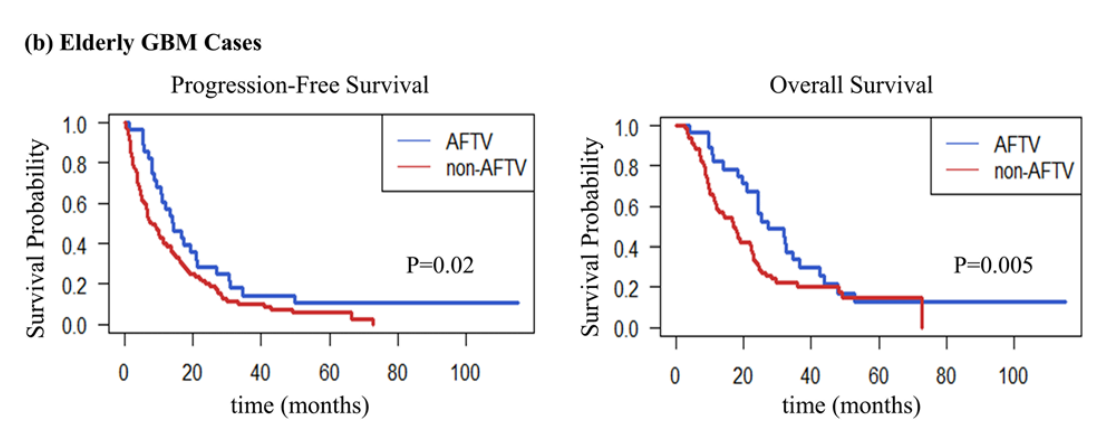
Fig.1 (b) 出典: Koriyama, S. et al., 2025. Brain Tumor Pathology, 42:76–86, Fig. 1. CC BY 4.0. 詳細はPubMedをご参照ください。
分子病理学的背景との関連
自家がんワクチン(AFTV)の効果は、患者さんの腫瘍の分子病理学的特徴によって異なることが報告されています。以下に主要な因子ごとの傾向を整理しました。
| 因子 | 状態 | PFS/OSの傾向 |
|---|---|---|
| IDH変異型 | 変異あり | 効果は乏しい(PFS/OSに有意差なし) |
| IDH野生型 | 野生型 | 明確な延長効果 PFS 16.2か月 vs 6.3か月 OS 34.2か月 vs 22.9か月 (p<0.01) |
| p53 | 陰性 | OS改善 35.3か月 vs 24.8か月 (p=0.03) |
| p53 | 陽性 | 効果減弱 |
| PD-L1 | 陰性 | OS 36.1か月 vs 28.3か月 (p=0.03)、顕著な延長効果 |
| PD-L1 | 陽性 | 効果は限定的 |
| p53 + PD-L1 | 二重陽性 | 最も予後不良(OS 24.5か月) |
| p53 + PD-L1 | 二重陰性 | 最良の予後(OS 35.3か月) |
※ Koriyama et al., 2025. Brain Tumor Pathology, 42:76–86 より作成。
AFTVの効果は腫瘍の分子病理によって異なることが示されています。術後の病理結果(IDH、p53、PD-L1など)を踏まえて適応を検討します。
効果が出やすい傾向
- IDH野生型:OS中央値 34.2か月(非投与 22.9か月)
- p53陰性:OS中央値 35.3か月
- PD-L1陰性:PFS中央値 19.1か月(陽性 9.8か月)、OS中央値 36.1か月(陽性 28.3か月)
効果が限定的な傾向
- p53陽性 × PD-L1陽性:免疫抑制的な腫瘍微小環境のため、AFTV単独効果は弱い可能性
※将来的に免疫チェックポイント阻害薬との併用で効果向上の可能性が指摘されています。
タイミングが重要:摘出腫瘍が材料となります。患者様の免疫を軸にしているため、活動性の自己免疫疾患を有する方や終末期にあり全身状態が著しく不良な方は、適応外となります。最適な治療開始時期は、手術前〜直後(化学療法を開始する前)です。
研究の信頼性と限界
Koriyama et al. (2025) の研究は 後ろ向き患者対象コホート研究として実施されました。 これは、2006年から2021年に東京女子医科大学で診断された膠芽腫患者の既存データを用いて、AFTV療法の効果を評価したものです。
研究の特徴と信頼性:
- 患者は過去に治療を受けたデータをもとに解析
- AFTV群(164例)と非AFTV群(211例)を比較
- 分子病理学的マーカー(IDH、p53、PD-L1)による効果の差も評価
後ろ向き研究の限界:
- ランダム割付がないため、群間に年齢や腫瘍特性の差がある
- 交絡因子の影響を完全に除外できない可能性
- 観察研究のため、因果関係の証明は限定的
この問題への対応:
後ろ向き研究のバイアスを克服するため、現在は ランダム化比較試験(RCT)が進行中 です。
「Cellm-001による初発膠芽腫治療効果無作為比較対照試験」(Japan Registry of Clinical Trials n.d.)
AFTV療法の効果を標準治療と比較する多施設RCTを実施しており、前向きランダム化比較試験により厳密な因果関係の評価が可能となります。 2025年現在進行中の東京女子医科大学での医師主導第III相治験(Muragaki et al. 2025)により、年齢・性別・腫瘍特性などの交絡因子の影響を最小化し、AFTVの有効性をより正確に確認することが期待されています。
症例紹介1:自家がんワクチンで長期生存した患者さん
Koriyama et al. (2025) の研究では、62歳の女性患者が対象となった症例が報告されています。
診断と治療経過:
患者さんは進行性の失語症(言語障害)と右半身麻痺(右半身の筋力低下)で受診され、MRI検査では左前頭葉および頭頂葉に複数の造影病変が認められました。
患者さんは腫瘍摘出手術に加え、光線力学療法(PDT)による肉眼的全摘出(Gross Total Resection: GTR)を実施。その後、自家がんワクチン(AFTV)療法を受けました。
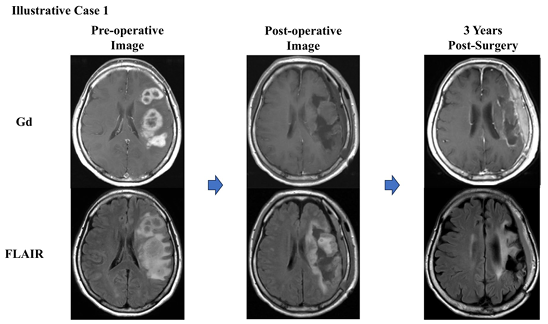
出典: Koriyama, S. et al., 2025. Brain Tumor Pathology, 42:76–86, Fig. 2. CC BY 4.0. 詳細はPubMedをご参照ください。
治療結果:
- 術後9年間再発なしで経過観察中
- 言語障害や半身麻痺は残りましたが、Karnofsky Performance Status(KPS)60を維持
- 微小な残存腫瘍に対しても免疫が持続的に働き、長期制御に成功
この症例は、AFTV療法が標準治療では対応が難しい微小残存腫瘍に対しても有効である可能性を示しており、高齢者や再発リスクの高い患者さんにとって新しい希望となり得ます。
注意:※効果には個人差があります。すべての患者に同様の効果を保証するものではありません。
お問い合わせ・ご予約
いわた脳神経外科クリニックでの自家がんワクチンのご予約は、下記から可能です。
症例紹介2:再発後にも治療効果を示した例
右半盲(右側視野が見えない)の59歳女性の例も紹介されています(Koriyama et al. 2025) 。
診断と治療経過:
MRIで左後頭葉に造影剤反応を示す病変が確認されました。
他の施設で腫瘍を完全切除(GTR)した後、放射線治療、化学療法(TMZ)、そして自家がんワクチン(AFTV)療法が行われました。
再発とその後の治療:
初回治療後6か月以内に再発が確認され、再度腫瘍切除が行われました。再発部位には光線力学療法(PDT)も併用されました。
さらに6か月後に再発し、再度腫瘍切除が行われましたが、この時点では病理学的に腫瘍細胞はほとんど見られず、主に壊死組織が確認されました。
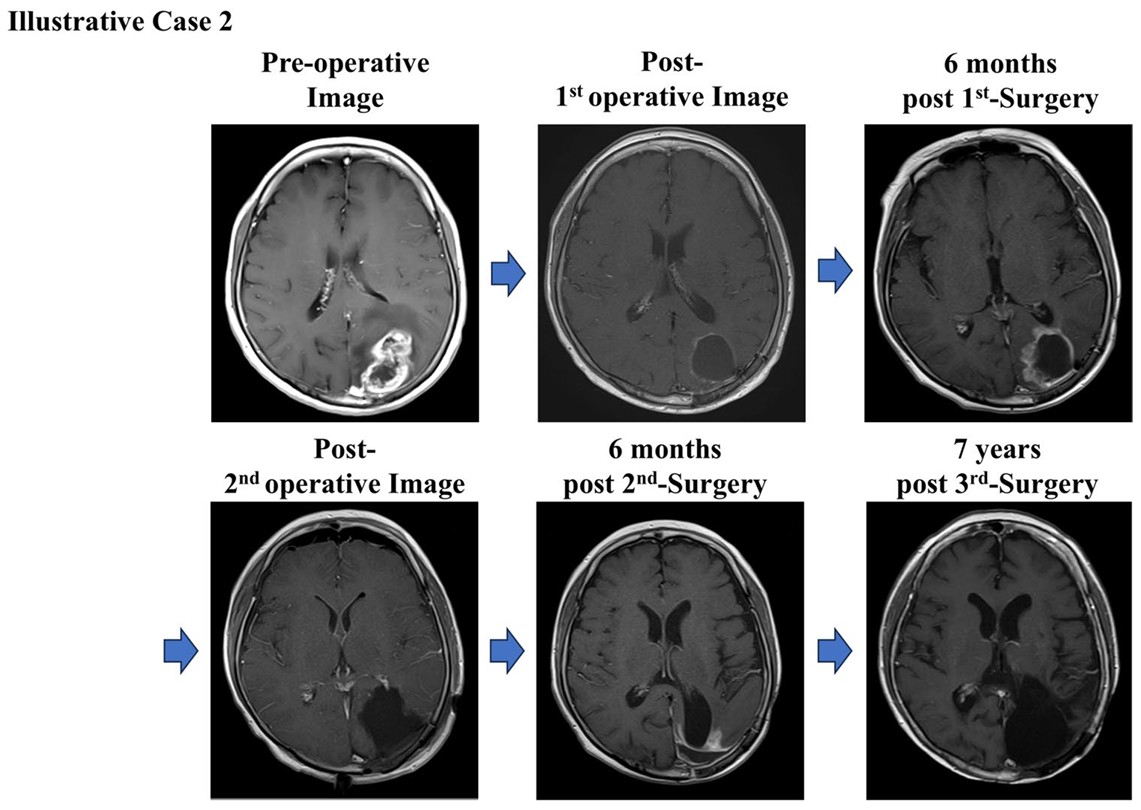
出典: Koriyama, S. et al., 2025. Brain Tumor Pathology, 42:76–86, Fig. 3. CC BY 4.0. 詳細はPubMedをご参照ください。
治療結果:
- 7年間再発なしで経過観察中
- 総生存期間は8年間
- Karnofsky Performance Status(KPS)80を維持
- AFTV療法により、再発後にも免疫応答が働き、遅発性の治療効果を発揮
免疫微小環境
共通所見: CD3+・CD8+T細胞は浸潤していたが、CD4+T細胞は稀。
PD-L1陽性例: CD4陽性細胞の増加傾向 → Tregの関与が示唆。
この症例は、AFTV療法が早期再発例においても有効性を示し、標準治療では対応が難しい残存腫瘍や微小病変に対しても長期にわたり制御効果を発揮する可能性があることを示しています。
メリットとデメリット
メリット
- オーダーメイド:ご本人の腫瘍抗原に合わせて残存腫瘍を狙い撃ち
- 安全性:重篤な副作用の報告は少なく、標準治療と併用可能
- 適応の広がり:高齢者・早期再発例でも有効性の示唆
- 長期効果の可能性:長期無再発や長期生存の症例が報告
- これまでの臨床試験で重篤な副作用の報告はありませんが、今後新たな副作用が判明する可能性はあります。
デメリット
- 手術が前提:摘出腫瘍が必要
- 個人差:p53/PD-L1/IDHなどの分子所見で効果が変動
- 自由診療:現時点では標準治療ではなく、保険適用外
よくあるご質問(FAQ)
Q. どのタイミングで検討すべきですか?
A. 手術前〜手術直後の検討が理想です。摘出腫瘍を材料に作るため、術前から準備しておくと、この免疫療法の機会を逃しにくくなります。
※適応の可否は最終的に担当医が医学的見地から判定いたします。
Q. 高齢でも受けられますか?
A. 65歳以上でも有効性が確認されています(AFTV群OS中央値 27.3か月 vs 17.0か月)。
Q. 保険は使えますか?
A. 現時点では自由診療となる場合が多いです。※治療費は医療費控除の対象となり得る場合があります。 詳細はお住まいの地域を管轄する税務署にご確認ください。
Q. p53陽性の意味は何ですか?
A. p53陽性の場合、腫瘍細胞内でp53タンパク質が異常に高いレベルで発現していることを示します。この場合、通常はp53遺伝子に変異があることが多いです。異常なp53タンパク質は、正常な細胞の修復メカニズムを妨げ、がん細胞の増殖を助ける可能性があります。
まとめ
自家がんワクチン(AFTV)は、膠芽腫に対して新たな治療選択肢となり得ます。AFTV群ではPFS・OSが有意に延長し、65歳以上や早期再発例でも有効性が示唆されています。術前・術後すぐの段階でご相談いただくことが、機会を逃さない鍵です。
- ①有効集団:IDH野生型、p53陰性、PD-L1陰性(強い免疫反応が得られる可能性が高い)
- ②抵抗性因子:IDH変異、p53変異、PD-L1発現
- IDH変異:2-HG産生による免疫抑制環境
- p53変異:Treg誘導、エフェクターT細胞抑制
- PD-L1発現:免疫逃避機構
- ③高齢者・早期再発例でも効果を示唆。安全性も高い。PD-L1陽性例には、AFTV+ICI併用戦略の可能性あり。
お問い合わせ・ご予約
いわた脳神経外科クリニックでの自家がんワクチンのご予約は、下記から可能です。
ご相談を検討されている方へ
ご自身の病状と向き合い、最適な治療法を考えたい方は、ぜひ一度当院へご相談ください。患者さん一人ひとりの状況に合わせて、納得できる選択ができるよう全力で支援します。
- 自家がんワクチンは、医薬品医療機器等法に基づく承認を受けていない未承認医薬品です。
- この治療は、公的医療保険が適用されない自由診療(全額自己負担)です。
- これまで報告されている副作用は限定的ですが、今後新たな副作用が明らかとなる可能性は否定できません。
- 当院は「いわた脳神経外科クリニック」であり、ワクチンの製造・開発はバイオ企業「セルメディシン株式会社」が行っています。
参考文献
- Koriyama, S., Muragaki, Y., Nitta, M., Maruyama, T., Saito, T., Tsuzuki, S., Kobayashi, T., Ro, B., Komori, T., Masui, K. & Kawamata, T., 2025. Association between autologous formalin-fixed tumor vaccine (AFTV) therapy, molecular pathological markers, and survival outcomes in glioblastoma. Brain Tumor Pathology, 42, pp.76–86. Available at: PubMed.
- Sener, U., Ruff, M.W. & Campian, J.L., 2022. Immunotherapy in glioblastoma: current approaches and future perspectives. International Journal of Molecular Sciences, 23, 7046.
- Ishikawa, E., Muragaki, Y., Yamamoto, T. et al., 2014. Phase I/IIa trial of fractionated radiotherapy, temozolomide, and autologous formalin-fixed tumor vaccine for newly diagnosed glioblastoma. Journal of Neurosurgery, 121, pp.543–553.
- Muragaki, Y., Maruyama, T., Iseki, H. et al., 2011. Phase I/IIa trial of autologous formalin-fixed tumor vaccine concomitant with fractionated radiotherapy for newly diagnosed glioblastoma. Journal of Neurosurgery, 115, pp.248–255.
- Muragaki, Y., Ishikawa, E., Maruyama, T. et al., 2023. A multicenter, randomized, placebo-controlled phase IIb trial of an autologous formalin-fixed tumor vaccine for newly diagnosed glioblastomas. Journal of Neurosurgery, 139, pp.344–354.
- Japan Registry of Clinical Trials, 2020. A multicenter, randomized, placebo-controlled Phase III trial of autologous formalin-fixed tumor vaccine (AFTV) in newly diagnosed glioblastoma (jRCT2031200153). Available at: https://jrct.mhlw.go.jp/latest-detail/jRCT2031200153.
- Muragaki, Y., Maruyama, T., Ishikawa, E. et al., 2023. Protocol of a multicenter, randomized, placebo-controlled Phase III trial of autologous formalin-fixed tumor vaccine (AFTV) in newly diagnosed glioblastoma. Japanese Journal of Clinical Oncology, 55(8), pp.975–985. Available at: https://academic.oup.com/jjco/article-abstract/55/8/975/8133653.
※ 本記事に記載の成績(PFS/OS、サブグループ、症例提示 等)は上記論文に基づきます。
より詳しく知りたい方はこちらもご覧ください。
脳腫瘍(膠芽腫)に対する自家がんワクチン(AFTVac)担当医師紹介
担当医師:岩田亮一
研究歴:悪性脳腫瘍に対する免疫治療の開発

2020年度 日本脳神経外科学会奨励賞受賞の様子
担当医師の想い
大学で悪性脳腫瘍のがん幹細胞を標的とした治療法の開発に取り組んできました。
免疫とは、自然免疫と獲得免疫があります。
自然免疫とは、生まれつき体に備わっている防御機能で、ウィルスや細菌などが体内に入るとすぐに反応し、皮膚や粘膜で侵入を防いだり、白血球が異物を食べて処理したり、炎症を起こして他の免疫細胞を呼び寄せる働きをします。
獲得免疫とは、外的となる抗原(マーク)を樹状細胞が認識し、T細胞やB細胞が標的(がん)を攻撃することです。
がんは遺伝子の変異で発生しますが、遺伝子変異によりがん抗原を持っています。これらを標的とする免疫治療の開発が試みられてきましたが、がんは免疫から逃れる仕組みを複数持っており、有効な免疫治療の開発が難しいです。
自家がんワクチンは、単一の特定のがん抗原を標的とするのではなく、自分自身のがん組織を用いて、ワクチンにより免疫誘導(獲得免疫)を起こします。
手術で最大限の摘出、放射線・化学療法との併用で、がんの再発期間を延長することが期待できます。
担当医師の脳腫瘍に関する業績
脳腫瘍に関する論文
●Maruyama, M., Nakano, Y., Nishimura, T., Iwata, R., Matsuda, S., Hayashi, M., Nakai, Y. & Nonaka, M. et al. (2021) PC3-Secreted Microprotein Is Expressed in Glioblastoma Stem-Like Cells and Human Glioma Tissues. Biological & Pharmaceutical Bulletin, 44(7), pp. 910–919.
●Iwata, R., Lee, J.H., Hayashi, M., Dianzani, U., Ofune, K., Maruyama, M., Oe, S., Ito, T., Hashiba, T. & Yoshimura, K. et al. (2020) ICOSLG-mediated regulatory T-cell expansion and IL-10 production promote progression of glioblastoma. Neuro-Oncology, 22(3), pp. 333–344.
●Iwata, R., Maruyama, M., Ito, T., Nakano, Y., Kanemura, Y., Koike, T., Oe, S., Yoshimura, K., Nonaka, M. & Nomura, S. et al. (2017) Establishment of a tumor sphere cell line from a metastatic brain neuroendocrine tumor. Medical Molecular Morphology, 50(4), pp. 211–219.
●Iwata, R. & Asai, A. (2016) Treatment of metastatic brain tumor. Nihon Rinsho. Japanese Journal of Clinical Medicine, 74(Suppl 7), pp. 752–756.
●Kim, S-H., Ezhilarasan, R., Phillips, E., Gallego-Perez, D., Sparks, A., Taylor, D., Ladner, K., Furuta, T., Sabit, H., Chhipa, R., Iwata, R. & Nakano, I. et al. (2016) Serine/Threonine Kinase MLK4 Determines Mesenchymal Identity in Glioma Stem Cells in an NF-κB-dependent Manner. Cancer Cell, 29(2), pp. 201–213.
●岩田 亮一, 丸山 正人, 大舟 晃平, 中野 洋輔, 大江 総一, 林 美樹夫, 吉村 晋一, 埜中 正博, 淺井 昭雄 (2018) 転移性脳腫瘍とがん幹細胞の関連. Cytometry Research, 28(1), pp.13–18. doi:10.18947/cytometryresearch.28.1_13.
岩田 亮一, 淺井 昭雄 (2016) 【脳腫瘍学-基礎研究と臨床研究の進歩-】転移性脳腫瘍 転移性脳腫瘍の治療. 日本臨床, 74巻増刊7 脳腫瘍学, pp.752–756.
競争的研究費
●科研費 若手研究(B) 2015-2017
B7 familyを標的にした膠芽腫の癌幹細胞に対する新規治療法の開発
役割:研究代表者
●科研費 基盤研究(C) 2015-2018
グリオーマ癌幹細胞を標的とした樹状細胞療法の開発に関する基礎研究
研究代表者:淺井昭雄、役割:研究分担者
●科研費 基盤研究(C) 2017-2020
グリオーマ癌幹細胞特異的に発現する新規バイオマーカーの機能解析
研究代表者:丸山正人、役割:研究分担者
●科研費 基盤研究(C) 2018-2020
グリオーマ幹細胞を用いたがん組織表現型と遺伝子発現への麻酔薬の影響の検討
研究代表者:岩井鉄平、役割:研究分担者
●科研費 基盤研究(C) 2018-2020
グリオーマがん幹細胞におけるOX40シグナルの機能解析
研究代表者:淺井昭雄 役割:研究分担者
●科研費 若手研究 2019-2020
脳転移開始細胞を用いた脳転移の機序解明
役割:研究代表者
●科研費 基盤研究(C) 2020-2022
内向き整流Kチャネルを基軸としたグリオーマ浸潤メカニズムの解明
研究代表者:吉村晋一、役割:研究分担者
●公益財団法人 赤枝医学研究財団 研究助成金
脳転移開始細胞を標的とした新規がん治療法の開発