自家がんワクチン
当院「いわた脳神経外科クリニック」におきましては、難治性の悪性脳腫瘍である膠芽腫に対し、 自家がんワクチン療法の提供を開始する運びとなりましたので、ここにご報告いたします。
膠芽腫(Glioblastoma、グリオブラストーマ)は、脳腫瘍の中で最も悪性度が高く、 進行が速い上に、周囲の正常な脳組織にしみ込むように広がる性質を持っています。 このため、手術で完全に取り除くことは非常に難しいのが現状です。
現行の標準治療について
膠芽腫に対する現行の標準治療は、外科的切除、放射線治療、化学療法を組み合わせた集学的治療が基本です。
第4の治療選択肢としての免疫療法
膠芽腫は根治が困難であるがゆえに、病勢の進行抑制や症状緩和を目的とする治療が主眼となる場合が少なくありません。 その中で第4の治療法として注目されているのが免疫療法です。
免疫療法は、ご自身の免疫細胞の力を利用してがんと闘う、新しいアプローチの治療法です。 特に「がん免疫チェックポイント阻害薬」の登場により、世界的に広く関心を集めています。
自家がんワクチン療法は、患者さんご自身の手術で摘出されたがん組織を基にワクチンを作製し、 ご自身のがんに対して特異的な免疫反応を引き起こすことを目的とした個別化医療です。
目次
自家がんワクチン療法とは?
自家がんワクチン療法は、患者さんご自身の手術で摘出されたがん組織を原材料として、専用の技術でワクチンに加工し、免疫反応を誘導するものです。 これは「個別化免疫療法(オーダーメイド治療)」と位置づけられています。
【世界における独自技術】
本療法においては、生のがん細胞や組織を新たに必要とするものではありません。 たとえ何年も前に摘出されたものであっても、ホルマリンで固定され、パラフィンで包まれた病理検査用の組織を利用してワクチン製造が可能です。 この技術は国際特許を取得済みであり、セルメディシン株式会社のみが提供できます。
治療の作用機序と安全性
作用の仕組みについて
このワクチンを投与すると、免疫細胞ががん細胞特有の目印(ネオアンチゲン)を学習し、これを標的として攻撃する能力を獲得します。 その結果、手術で取りきれなかった微小ながん細胞や、転移・再発したがん細胞に対しても、ご自身の免疫による攻撃が可能になることを目的としています。
【安全性と特異性について】
自家がんワクチンは、がん細胞だけを選択的に攻撃することを目的としており、正常な細胞への影響は限定的だと報告されています。 これまでの臨床試験では重篤な副作用の報告は確認されていません。
※免疫反応を強力に引き起こす性質があるため、自己免疫疾患をお持ちの方には原則として投与できません。
どのようながんに効果が期待できますか?
提供元であるセルメディシン株式会社の調査に基づき、本療法の適応および臨床効果について情報が公開されております。 臨床試験データに加え、実際の症例報告においても一定の有効性が示唆されています。
詳細につきましては、セルメディシン株式会社が運営する公開症例データをご参照ください。
※効果には個人差があります。すべての患者に同様の効果を保証するものではありません。
がん種別全体の治療成績表
膠芽腫の症例
治療を受けるまでの流れ
がん組織の確保
本療法の実施にあたっては、患者ご本人のがん組織(ホルマリン固定組織またはパラフィンブロック)が必須です。
この治療には、患者さんご本人のがん組織(ホルマリン固定組織またはパラフィンブロック)が必須です。過去に手術で摘出された組織も利用できますので、手術を受けた医療機関に組織の貸出しを依頼してください。ご自身での依頼が難しい場合は、当院で手続きを支援します。
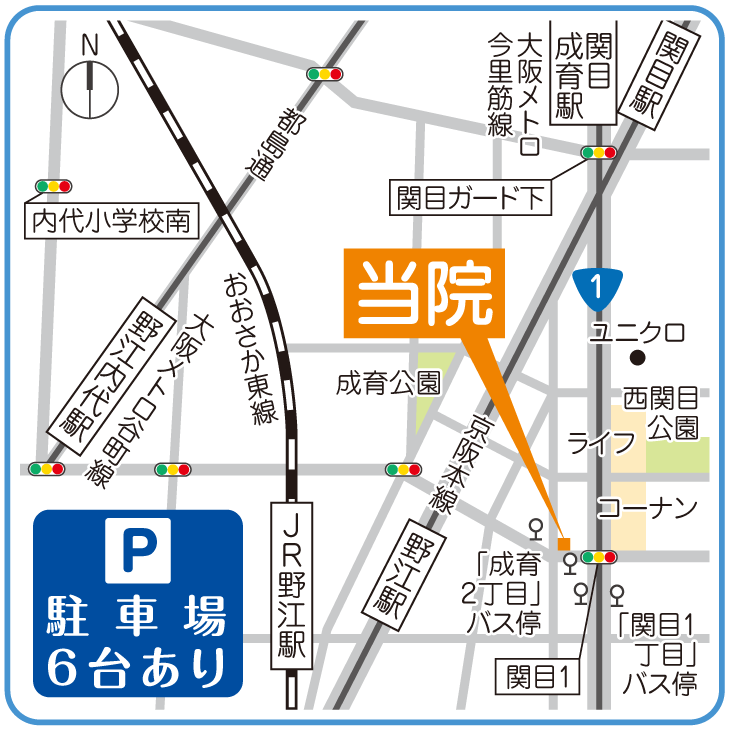
受診・ご相談
初診予約をお取りいただき、確保されたがん組織をご持参のうえ、担当医と治療適応および方針について協議を行います。 適応可否については医師が慎重に判定いたします。
いわた脳神経外科クリニックのご予約は下記から可能です。(※現在、予約準備中です。)
ワクチン製造と投与
がん組織のお預かりからおおむね1~2週間でワクチンが完成いたします。 入院は不要で、外来通院にて接種を行います。 1コースは、ワクチン接種3回であり、約4~6週間の期間を要します。
最適な治療開始時期
体内に残っているがん細胞が少ないと考えられる、手術後で化学療法を開始する前の時期が、最も望ましいタイミングです。放射線治療や一部の化学療法、免疫チェックポイント阻害剤との併用も可能です。ただし、全身状態が著しく低下している場合は適応外となります。
治療に要する費用について
自家がんワクチン療法は、現行の公的医療保険制度の適用対象外のため、 自由診療となります。
1コース:165万円(税込)
(内訳:ワクチン接種3回)
相談料:3万3000円(税込)
※治療費は医療費控除の対象となり得る場合があります。 詳細はお住まいの地域を管轄する税務署にご確認ください。
よくあるご質問 (Q&A)
Q. どのような副作用がありますか。
A. 主な副作用は、注射した部位の赤み、腫れ、硬くなるなどの局所的な反応です。これらは免疫が反応している証拠であり、通常は一時的なものです。まれに軽度の発熱を伴うこともあります。これまでの臨床試験で重篤な副作用の報告はありませんが、今後新たな副作用が判明する可能性はあります。
Q. 他の治療法と併用できますか。
A. はい、併用は可能です。放射線治療や、リンパ球を強く抑制しないタイプの抗がん剤、免疫チェックポイント阻害薬と併用することで、相乗効果が期待できるという報告があります。適切な治療計画は、医師と相談の上で決定します。
Q. 誰でもこの治療を受けられますか。
A. 以下の条件に該当する方は、原則として適応外となります。
・がん組織を確保できない方
・活動性の自己免疫疾患を有する方
・終末期にあり全身状態が著しく不良な方
・妊娠中または授乳中の方
※適応の可否は最終的に担当医が医学的見地から判定いたします。
Q. 治療効果はどのように判定するのですか。
A. 画像検査(CT、MRI、PETなど)を用い、 標準的ながん治療に準じた方法で総合的に評価いたします。 さらに、体調の変化や生活の質(QOL)の改善も重要な指標と位置づけております。
ご相談を検討されている方へ
ご自身の病状と向き合い、最適な治療法を考えたい方は、ぜひ一度当院へご相談ください。患者さん一人ひとりの状況に合わせて、納得できる選択ができるよう全力で支援します。
- 自家がんワクチンは、医薬品医療機器等法に基づく承認を受けていない未承認医薬品です。
- この治療は、公的医療保険が適用されない自由診療(全額自己負担)です。
- これまで報告されている副作用は限定的ですが、今後新たな副作用が明らかとなる可能性は否定できません。
- 当院は「いわた脳神経外科クリニック」であり、ワクチンの製造・開発はバイオ企業「セルメディシン株式会社」が行っています。
担当医師紹介
担当医師:岩田亮一
研究歴:悪性脳腫瘍に対する免疫治療の開発

2020年度 日本脳神経外科学会奨励賞受賞の様子
担当医師の想い
大学で悪性脳腫瘍のがん幹細胞を標的とした治療法の開発に取り組んできました。
免疫とは、自然免疫と獲得免疫があります。
自然免疫とは、生まれつき体に備わっている防御機能で、ウィルスや細菌などが体内に入るとすぐに反応し、皮膚や粘膜で侵入を防いだり、白血球が異物を食べて処理したり、炎症を起こして他の免疫細胞を呼び寄せる働きをします。
獲得免疫とは、外的となる抗原(マーク)を樹状細胞が認識し、T細胞やB細胞が標的(がん)を攻撃することです。
がんは遺伝子の変異で発生しますが、遺伝子変異によりがん抗原を持っています。これらを標的とする免疫治療の開発が試みられてきましたが、がんは免疫から逃れる仕組みを複数持っており、有効な免疫治療の開発が難しいです。
自家がんワクチンは、単一の特定のがん抗原を標的とするのではなく、自分自身のがん組織を用いて、ワクチンにより免疫誘導(獲得免疫)を起こします。
手術で最大限の摘出、放射線・化学療法との併用で、がんの再発期間を延長することが期待できます。
担当医師の脳腫瘍に関する業績
脳腫瘍に関する論文
●Maruyama, M., Nakano, Y., Nishimura, T., Iwata, R., Matsuda, S., Hayashi, M., Nakai, Y. & Nonaka, M. et al. (2021) PC3-Secreted Microprotein Is Expressed in Glioblastoma Stem-Like Cells and Human Glioma Tissues. Biological & Pharmaceutical Bulletin, 44(7), pp. 910–919.
●Iwata, R., Lee, J.H., Hayashi, M., Dianzani, U., Ofune, K., Maruyama, M., Oe, S., Ito, T., Hashiba, T. & Yoshimura, K. et al. (2020) ICOSLG-mediated regulatory T-cell expansion and IL-10 production promote progression of glioblastoma. Neuro-Oncology, 22(3), pp. 333–344.
●Iwata, R., Maruyama, M., Ito, T., Nakano, Y., Kanemura, Y., Koike, T., Oe, S., Yoshimura, K., Nonaka, M. & Nomura, S. et al. (2017) Establishment of a tumor sphere cell line from a metastatic brain neuroendocrine tumor. Medical Molecular Morphology, 50(4), pp. 211–219.
●Iwata, R. & Asai, A. (2016) Treatment of metastatic brain tumor. Nihon Rinsho. Japanese Journal of Clinical Medicine, 74(Suppl 7), pp. 752–756.
●Kim, S-H., Ezhilarasan, R., Phillips, E., Gallego-Perez, D., Sparks, A., Taylor, D., Ladner, K., Furuta, T., Sabit, H., Chhipa, R., Iwata, R. & Nakano, I. et al. (2016) Serine/Threonine Kinase MLK4 Determines Mesenchymal Identity in Glioma Stem Cells in an NF-κB-dependent Manner. Cancer Cell, 29(2), pp. 201–213.
●岩田 亮一, 丸山 正人, 大舟 晃平, 中野 洋輔, 大江 総一, 林 美樹夫, 吉村 晋一, 埜中 正博, 淺井 昭雄 (2018) 転移性脳腫瘍とがん幹細胞の関連. Cytometry Research, 28(1), pp.13–18. doi:10.18947/cytometryresearch.28.1_13.
岩田 亮一, 淺井 昭雄 (2016) 【脳腫瘍学-基礎研究と臨床研究の進歩-】転移性脳腫瘍 転移性脳腫瘍の治療. 日本臨床, 74巻増刊7 脳腫瘍学, pp.752–756.
競争的研究費
●科研費 若手研究(B) 2015-2017
B7 familyを標的にした膠芽腫の癌幹細胞に対する新規治療法の開発
役割:研究代表者
●科研費 基盤研究(C) 2015-2018
グリオーマ癌幹細胞を標的とした樹状細胞療法の開発に関する基礎研究
研究代表者:淺井昭雄、役割:研究分担者
●科研費 基盤研究(C) 2017-2020
グリオーマ癌幹細胞特異的に発現する新規バイオマーカーの機能解析
研究代表者:丸山正人、役割:研究分担者
●科研費 基盤研究(C) 2018-2020
グリオーマ幹細胞を用いたがん組織表現型と遺伝子発現への麻酔薬の影響の検討
研究代表者:岩井鉄平、役割:研究分担者
●科研費 基盤研究(C) 2018-2020
グリオーマがん幹細胞におけるOX40シグナルの機能解析
研究代表者:淺井昭雄 役割:研究分担者
●科研費 若手研究 2019-2020
脳転移開始細胞を用いた脳転移の機序解明
役割:研究代表者
●科研費 基盤研究(C) 2020-2022
内向き整流Kチャネルを基軸としたグリオーマ浸潤メカニズムの解明
研究代表者:吉村晋一、役割:研究分担者
●公益財団法人 赤枝医学研究財団 研究助成金
脳転移開始細胞を標的とした新規がん治療法の開発
お問い合わせはこちらから
また当院公式LINEにてご質問等をお受けしておりますので、お気軽にお問い合わせくださいませ。